Clinical and Translational Medicine:T细胞受体β链TRBV6-6可提示EGFR阳性非小细胞肺癌不良预后
ADJUVANT系列-肺癌-吴一龙教授、李扬秋研究员
导语
此前,在ADJUVANT系列研究中已探索性地对入组的非小细胞肺癌(NSCLC)患者的手术组织样本进行了T细胞受体β链测序,并从免疫组库多样性等层面初步探究了免疫微环境复杂性与EGFR驱动阳性NSCLC患者辅助靶向治疗疗效的相关性。而对于特定的TCR克隆型及EGFR共突变基因如何进一步影响辅助治疗的疗效,广东省人民医院吴一龙教授研究团队、暨南大学血研所李扬秋研究员团队携手进行深入探索,研究成果发表于Clinical and Translational Medicine杂志(IF=11.492)【1】。该文还受邀在Clinical and Translational Discovery杂志发表述评,对内容进行深入讨论【2】。
研究亮点
本研究首次发现TCR克隆TRBV6-6与临床不良预后显著相关;
高频的Vβ6-6Jβ1-3和NKX2-1基因拷贝数增加能够共同预测EGFR突变II/III期NSCLC患者术后辅助治疗,尤其是辅助化疗不良预后。
研究结果
特定TCR克隆提示辅助治疗不良预后
研究者基于此前的结果,首先对TCR β链测序获得的TCR库中频率高于0.1%的144种TCR克隆与预后的相关性进行逐个分析,发现两个β链V基因Vβ6-6的克隆亚型,Vβ6-6Jβ1-3和Vβ6-6Jβ1-6的使用频率与较差的预后显著相关(矫正后p值分别为0.001和0.012)。
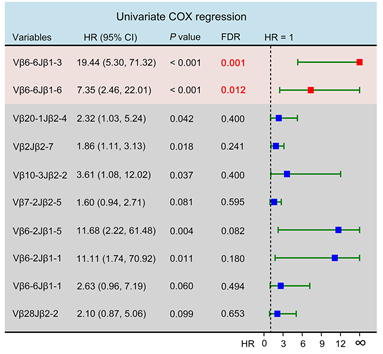
图1Vβ6-6Jβ1-3和Vβ6-6Jβ1-6与更差的OS及DFS相关
由于两个Vβ6-6克隆均与不良预后相关,研究者对比了Vβ6-6Jβ1-3和Vβ6-6Jβ1-6独立或组合后对患者预后的预测能力,并通过100次10X交叉验证进行确认,发现组合风险评分对总生存(OS)及无病生存(DFS)的预测效果远好于单个VJ:风险评分高低风险组OS风险比HR达到4.57(p<0.001),而Vβ6-6Jβ1-3和Vβ6-6Jβ1-6的HR分别为3.69和4.28(p<0.001)。DFS也是类似的结果:高低风险组DFS的HR为5.35,而Vβ6-6Jβ1-3和Vβ6-6Jβ1-6预测DFS的HR则分别为2.72和2.96。以上结果共同表明,特异性TCR重排(Vβ6-6Jβ1-3和Vβ6-6Jβ1-6)不仅本身具有预后预测的能力,使用风险评分同时考虑两种TCR重排情况,可以更好地对EGFR突变NSCLC患者的预后进行评估。
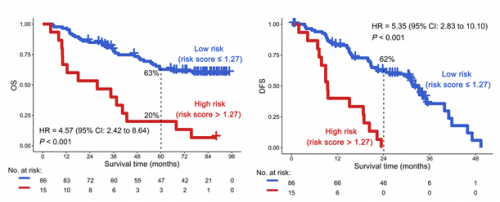
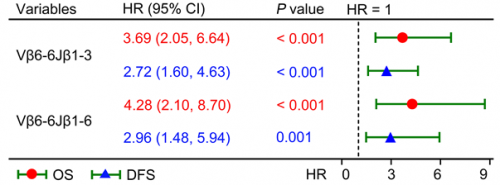
图2 Vβ6-6Jβ1-3和Vβ6-6Jβ1-6组合模型对预后的影响
此外,对接受辅助吉非替尼或长春瑞滨顺铂化疗的患者进行亚组分析也显示,两组中Vβ6-6Jβ1-3和Vβ6-6Jβ1-6各自或组合之后也均能提示手术切除的EGFR阳性NSCLC患者的不良预后(图2)。
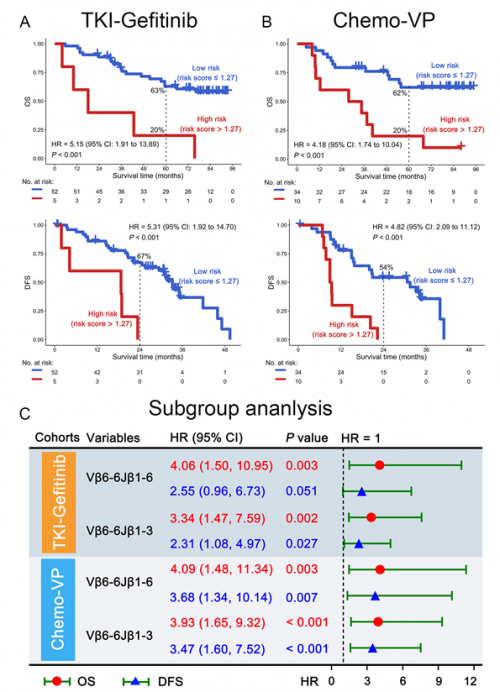
图3 TCR克隆对生存影响的亚组分析
高频TCR Vβ6-6克隆或参与免疫逃逸机制
为了确定Vβ6-6相关TCR的具体克隆型,研究者接下来分析了高频TCR组中Vβ6-6Jβ1-3和Vβ6-6Jβ1-6的CDR3可变区域的氨基酸序列。结果发现,除了CDR3两端的保守区域外,两个VB6-6克隆的CDR3区域均存在特定氨基酸序列的富集——这些可能是参与EGFR阳性NSCLC免疫逃逸的常见CDR3序列。其中,Vβ6-6Jβ1-3的前5个高频CDR3序列为YSGS、YSRS、YSIS、TLPA和YAGS;而Vβ6-6Jβ1-6的高频序列为YSESD、DRDGG、YSGGG、YSREG和PRGSP(图4)。这也提示我们,当Vβ6-6Jβ1-3或Vβ6-6Jβ1-6频率较高时,未来或可考虑使用Vβ6-6抗体等方案进行治疗。
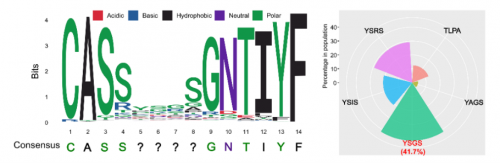

图4Vβ6-6Jβ1-3(上)和Vβ6-6Jβ1-6(下)的CDR3区域氨基酸序列及频率
特定TCR克隆结合基因拷贝数变化或可指导辅助化疗决策
肿瘤细胞发生的特异性突变可能促成抗原肽的产生,并在肿瘤细胞上生成一个新表位,进而被T细胞识别。那么在EGFR阳性患者中是否存在某些共突变与特定的TCR重排有关呢?结果显示,Vβ6-6Jβ1-3重排患者中NKX2-1拷贝数增加的频率明显高于Vβ6-6Jβ1-6重排的患者,并且Vβ6-6Jβ1-3的频率和NKX2-1拷贝数增加显著正相关。同时,与Vβ6-6Jβ1-3低和NKX2-1野生型患者相比,Vβ6-6Jβ1-3高频或/和NKX2-1拷贝数增加患者的OS和DFS更短,而这一差异在接受长春瑞滨顺铂化疗的患者中尤为明显(图5)。因此,同时评估Vβ6-6Jβ1-3频率与NKX2-1拷贝数增加这两个生物标志物,可能可以更精准地为早期可切除NSCLC患者辅助化疗决策提供指导。
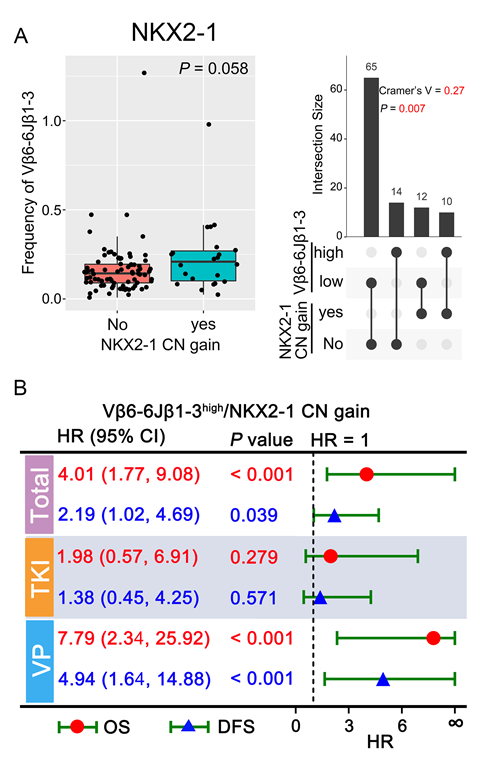
图5Vβ6-6Jβ1-3结合NKX2-1拷贝数变化与生存的相关性
结语
尽管EGFR突变肿瘤被认为是免疫原性偏低的冷肿瘤,肿瘤细胞特有的伴随突变仍然可能造成肿瘤免疫微环境及T细胞抗原识别上的差异。若能找到与肿瘤特有变异相关的新抗原及对应T细胞克隆,或可更好地解释不同患者接受辅助治疗为何存在疗效差异,并对后续个性化治疗方案的制定提供更多的指导。本研究在ADJUVANT试验入组患者中发现高频的TRBV6-6克隆,不仅对不良预后有着重要提示,同时也与重要伴随基因NKX2-1相关联,共同作为潜在的生物标志物,研究结果对未来探索EGFR突变型II/III期NSCLC患者的免疫治疗具有重要价值。
本研究使用了世和基因TCR免疫组库检测技术。
参考文献
[1]ChenC,LiuSM,ChenY,etal..Poorprognosisofintra-tumoralTRBV6-6variantsinEGFR-mutant NSCLC: resultsfromtheADJUVANT-CTONG1104 trial.Clin. Transl. Med.2022;12:e775.
[2]ChenC,LiuSM,WuYL,etal.Predictivevalueofintra-tumoural TCRβ rearrangements in precisely selecting adjuvanttherapyforEGFR-mutantnon-small-cell lung cancer.Clin. Transl. Disc. 2022;2:e46.